Descubre cómo se calcula la entropía y su importancia en la termodinámica y la física con nuestra guía completa sobre la fórmula de la entropía.
Fórmula de Entropía
La entropía es una función termodinámica que se usa para medir la aleatoriedad o el desorden de un sistema. Por ejemplo, la entropía de un sólido, donde las partículas no pueden moverse libremente, es menor que la entropía de un gas, donde las partículas llenarán el contenedor. Los científicos han llegado a la conclusión de que si un proceso debe ser espontáneo, la entropía de ese proceso debe aumentar. Esto incluye la entropía del sistema y la entropía del entorno.
La entropía puede calcularse usando muchas ecuaciones diferentes:
1. Si el proceso está a una temperatura constante, entonces, donde ΔS es el cambio en la entropía,
es el inverso del calor, y T es la temperatura de Kelvin.
2. Si la reacción es conocida, entonces ΔSrxn puede calcularse usando una tabla de valores de entropía estándar.
3. La energía libre de Gibbs (ΔG) y la entalpía (ΔH) también se pueden usar para calcular ΔS.
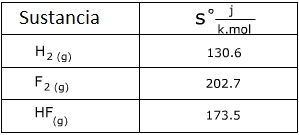
1. Calcula el cambio de entropía para la siguiente reacción usando la tabla de valores de entropía.
Responder:
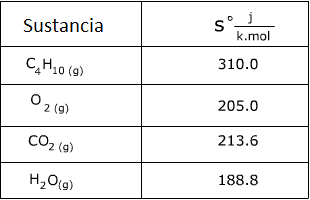
2. Calcule el cambio de entropía para la reacción usando la tabla de valores de entropía.