Aprende qué es la fórmula de entalpía y cómo se utiliza en la química. En nuestro artículo, te explicamos los conceptos básicos y te ofrecemos ejemplos prácticos para entender mejor esta fórmula.
Fórmula de Entalpía
La entalpía es una función termodinámica que es igual a la energía interna total del sistema más el producto de la presión y el volumen. La ecuación es la siguiente:
H = E + PV
donde H es la entalpía, E es la energía y PV es la presión multiplicada por el volumen.
La energía interna total de un sistema es imposible de calcular, pero los cambios en la energía interna sí pueden. Los cambios implican la transferencia de calor y el trabajo realizado (la expansión o contracción de un gas). Por lo tanto, la entalpía de una reacción se indica como ΔH, donde el símbolo Δ se refiere al cambio. El ΔH de la reacción se puede calcular de muchas maneras diferentes.
1. Si el trabajo realizado por o en un sistema es cero (el volumen del contenedor no cambia), entonces el cambio en la entalpia es igual a la transferencia de calor (q), donde . En esta ecuación, m es la masa, s es el calor específico, y ΔT es el cambio de temperatura.
2. Si se conoce la reacción, se puede usar una tabla de valores para calcular el
. El llamado calor de la formación se refiere al calor que se necesita para formar la sustancia a partir de sus elementos.
3. La Ley de Hess podría usarse para calcular la entalpía de una reacción.
4. El puede calcularse utilizando las energías de enlace de los reactivos y productos.
Preguntas sobre la fórmula de entalpía:
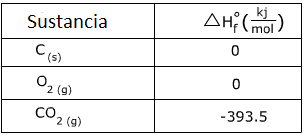
1. Calcule el calor de la siguiente reacción usando la tabla de
Responder:
El llamado calor de la formación se refiere al calor que se necesita para formar la sustancia a partir de sus elementos. Los para C (s) y O2 (g) tienen valores de 0 porque están en forma elemental.
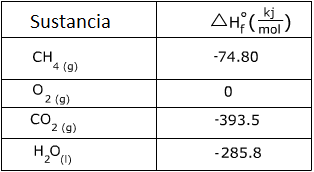
2. Calcule el calor de la siguiente reacción usando la tabla de valores.
Responder:
En este problema, hay 2 moles de O2 y 2 moles de H2O por lo que sus valores se deben multiplicar por dos.