¿Quieres conocer las partes que componen la tabla periódica de los elementos químicos? Aprende sobre los grupos, periodos y elementos que conforman esta herramienta fundamental en la química y descubre su organización y características principales.
¿Cuáles son las Partes de la Tabla Periódica?
La tabla periódica de elementos es la herramienta más importante utilizada en química. Para obtener el máximo provecho de la tabla, es útil conocer las partes de la tabla periódica y cómo utilizar el gráfico para predecir las propiedades del elemento.
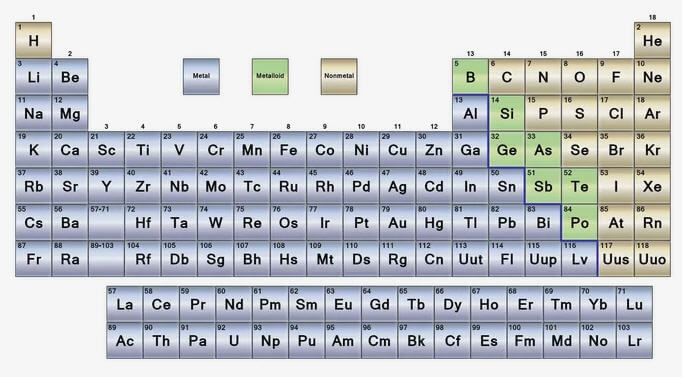
3 partes principales de la tabla periódica
La tabla periódica enumera los elementos químicos en orden de aumentar el número atómico, que es el número de protones en cada átomo de un elemento. La forma de la mesa y la forma en que se organizan los elementos tiene importancia.
Cada uno de los elementos se puede asignar a una de tres categorías amplias de elementos:
Metales
Con la excepción del hidrógeno, los elementos en el lado izquierdo de la tabla periódica son metales. En realidad, el hidrógeno también actúa como un metal en su estado sólido, pero el elemento es un gas a temperaturas y presiones normales y no presenta un carácter metálico en estas condiciones. Las propiedades del metal incluyen:
***lustre metálico
***Alta conductividad eléctrica y térmica.
***Sólidos duros habituales (el mercurio es líquido)
***generalmente dúctil (capaz de ser estirado en un alambre) y maleable (capaz de ser martillado en láminas delgadas)
***la mayoría tienen altos puntos de fusión
***perder fácilmente los electrones (baja afinidad de electrones)
***energías de baja ionización
Las dos filas de elementos debajo del cuerpo de la tabla periódica son metales. Específicamente, son una colección de metales de transición que se llaman lantánidos y actínidos o los metales de tierras raras.
Estos elementos están ubicados debajo de la mesa porque no había una manera práctica de insertarlos en la sección de metal de transición sin hacer que la mesa se viera extraña.
Metaloides (o Semimetales)
Hay una línea en zig-zag hacia el lado derecho de la tabla periódica que actúa como una especie de borde entre metales y no metales.
Los elementos a cada lado de esta línea exhiben algunas propiedades de los metales y algunos de los no metales. Estos elementos son los metaloides, también llamados semimetales. Los metaloides tienen propiedades variables, pero a menudo:
***Los metaloides tienen múltiples formas o alótropos.
***Se puede hacer para conducir electricidad en condiciones especiales (semiconductores).
No metales
Los elementos en el lado derecho de la tabla periódica son los no metales. Las propiedades no metálicas son:
***Usualmente malos conductores de calor y electricidad.
***A menudo líquidos o gases a temperatura y presión ambiente.
***falta de brillo metálico
***Ganar electrones fácilmente (alta afinidad de electrones)
***alta energía de ionización
Períodos y grupos en la tabla periódica
La disposición de la tabla periódica organiza elementos con propiedades relacionadas. Dos categorías generales son grupos y períodos:
Grupos de elementos
Los grupos son las columnas de la tabla. Los átomos de los elementos dentro de un grupo tienen el mismo número de electrones de valencia. Estos elementos comparten muchas propiedades similares y tienden a actuar de la misma manera en reacciones químicas.
Periodos del elemento
Las filas en la tabla periódica se llaman períodos. Los átomos de estos elementos comparten el mismo nivel más alto de energía de electrones.
Enlace químico para formar compuestos
Puede usar la organización de elementos en la tabla periódica para predecir cómo los elementos formarán enlaces entre sí para formar compuestos.
Enlaces iónicos
Los enlaces iónicos se forman entre átomos con valores de electronegatividad muy diferentes. Los compuestos iónicos forman redes cristalinas que contienen cationes cargados positivamente y aniones cargados negativamente. Los enlaces iónicos se forman entre metales y no metales. Debido a que los iones se fijan en su lugar en una red, los sólidos iónicos no conducen la electricidad. Sin embargo, las partículas cargadas se mueven libremente cuando los compuestos iónicos se disuelven en agua, formando electrolitos conductores.
Enlaces covalentes
Los átomos comparten electrones en enlaces covalentes. Este tipo de enlace se forma entre los átomos no metálicos. Recuerde que el hidrógeno también se considera un no metal, por lo que sus compuestos formados con otros no metales tienen enlaces covalentes.
Enlaces metálicos
Los metales también se unen a otros metales para compartir electrones de valencia en lo que se convierte en un mar de electrones que rodea a todos los átomos afectados.
Los átomos de diferentes metales forman aleaciones, que tienen propiedades distintas de sus elementos componentes. Debido a que los electrones pueden moverse libremente, los metales conducen fácilmente la electricidad.


