Descubre la fascinante historia detrás de la creación y evolución de la tabla periódica de los elementos, desde los primeros intentos de clasificación hasta su forma actual y su impacto en la química moderna.
Historial de Tabla Periódica
Aunque algunos elementos, como el oro y el hierro, han sido conocidos por los humanos desde tiempos prehistóricos, no fue hasta el siglo XVII que se hizo el primer descubrimiento científico de un elemento (fósforo). Solo se conocían 12 elementos antes de 1700, pero a medida que se descubrían más y más, para 1900 había más de 80, los científicos trataron de encontrar una manera de organizarlos sistemáticamente, de acuerdo con sus propiedades físicas y químicas.
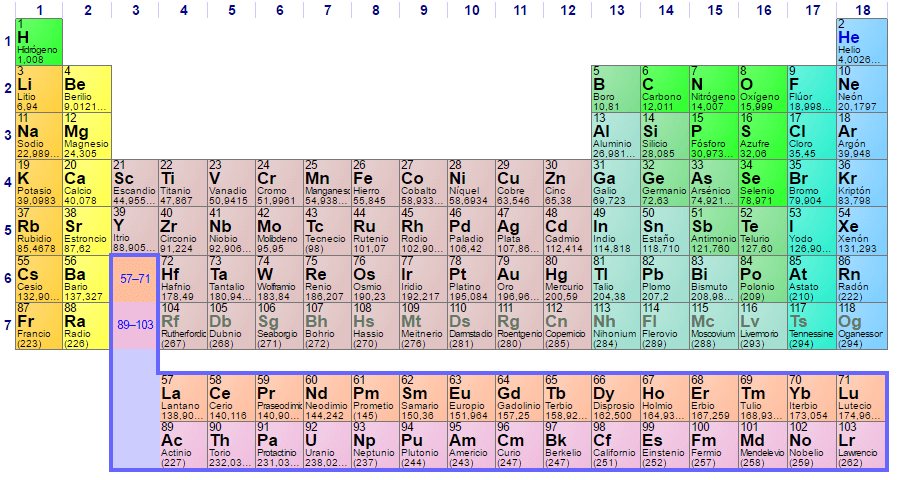
Hoy, la tabla periódica organiza los elementos en filas horizontales, o períodos, por orden de número atómico creciente, que es igual al número de protones en el núcleo atómico de cada elemento. Los elementos también están organizados en columnas verticales, o grupos, basados en características físicas y comportamiento químico similares. Esta disposición se desarrolló lado a lado con la teoría atómica durante unos 200 años y continúa evolucionando a medida que se descubren nuevos elementos.
Intentos tempranos
Uno de los primeros intentos de organizar los elementos en función de sus propiedades químicas y físicas fue el químico alemán Johann Dobereiner. En 1817, Dobereiner notó que ciertos elementos que eran químicamente similares podían agruparse en grupos de tres, por ejemplo, calcio, estroncio y bario; litio, sodio y potasio; Cloro, bromo y yodo. En cada grupo de tres, el peso atómico de un elemento cayó a mitad de camino entre los pesos atómicos de los otros dos elementos. El patrón parecía demasiado notable para ser una coincidencia. Basándose en sus hallazgos, Dobereiner propuso la Ley de las tríadas en 1829. Su trabajo pronto llevó a otros científicos a encontrar patrones entre grupos de elementos aún más grandes.
Otro intento de organizar sistemáticamente los elementos según sus propiedades fue realizado por el geólogo francés Alexandre-Émile Beguyer de Chancourtois en 1862. Él ideó una especie de gráfico en espiral que estaba dispuesto en un cilindro, con los elementos ordenados por el aumento del peso atómico y con Elementos similares alineados verticalmente. De Chancourtois fue el primero en notar la periodicidad de los elementos, es decir, cuando los elementos se organizaron de acuerdo con sus pesos atómicos, parecían ocurrir elementos similares a intervalos regulares.
Un año más tarde, el químico inglés John Newlands también intentó clasificar los elementos conocidos de su día según su peso atómico. Al igual que de Chancourtois, notó un patrón repetitivo: cada octavo elemento tenía propiedades similares. Newlands llamó a esto la Ley de Octavas. Aunque las tablas elaboradas por Chancourtois y Newlands fueron precursores importantes de la tabla periódica, ninguna recibió mucha atención en ese momento.
Mendeleev
El siguiente hito en el desarrollo de la tabla periódica fue establecido por el químico ruso Dmitri Mendeleev, quien generalmente es reconocido como el «padre» de la tabla periódica moderna. Mendeleev escribió los nombres de los elementos, junto con sus pesos atómicos y otras propiedades, en tarjetas, que luego dispuso en filas y columnas como un juego de solitario. Cuando los elementos se ordenaron de acuerdo con el peso atómico, Mendeleev, como Chancourtois y Newlands, pudo ver que ciertas propiedades químicas se repetían periódicamente; sin embargo, no todos los elementos encajan perfectamente en este patrón. La solución de Mendeleev fue mover ciertos elementos a nuevas posiciones, a pesar de su peso aceptado, para agruparlos con otros elementos que comparten propiedades similares. (Casi medio siglo después, después de que la tabla periódica se revisó según el número atómico en lugar del peso atómico, estos elementos se colocaron en su lugar).
El trabajo de Mendeleev sobre la ley periódica, que establece que las propiedades de los elementos se repiten periódicamente a medida que aumentan sus pesos atómicos, se anunció en 1869. Casi al mismo tiempo, un químico alemán llamado Julius Lothar Meyer llegó de forma independiente a una tabla periódica que era notablemente similar a De Mendeleev. Desafortunadamente para Meyer, Mendeleev presentó su trabajo a la comunidad científica primero. Sin embargo, la mesa de Mendeleev también era superior a la de Meyer porque dejó una serie de espacios vacíos para explicar los elementos que aún estaban por descubrir.
Revisiones del siglo XX
El primer cambio importante en la tabla periódica ocurrió después del descubrimiento de un grupo de elementos completamente nuevo, los gases nobles, entre 1895 y 1901. Se los llamó gases nobles porque se creía que eran inertes, incapaces de reaccionar con otros elementos para formar compuestos. (Hoy se sabe que entran en combinaciones químicas, solo a regañadientes). Estos elementos simplemente se agregaron en una columna separada bajo helio.
La primera revisión importante de toda la tabla periódica fue llevada a cabo por Henry Gwyn-Jeffries Moseley, un físico inglés que comenzó su investigación con Ernest Rutherford. En 1914, Moseley demostró que a cada núcleo atómico se le podría asignar un número que era igual al número de unidades de carga positiva (más tarde identificadas como «protones») asociadas con él. Una vez que la tabla periódica se reorganizó de acuerdo con este número atómico en lugar de su peso atómico, desaparecieron las pocas discrepancias en el sistema de Mendeleev.
A lo largo de los años, se han realizado otras revisiones de la tabla, incluida la incorporación de los elementos de tierras raras (series de lantánidos) y los elementos sintéticos (tecnecio, prometio y todos los elementos con número atómico 93 o superior). Los actínidos, que son radiactivos y principalmente sintéticos, y los lantánidos no encajan en el mismo patrón de propiedades repetidas que los otros elementos, por lo que generalmente se muestran debajo de la tabla periódica en filas separadas. La mayoría de estos cambios fueron obra del químico estadounidense Glenn Seaborg, quien descubrió de manera aleatoria los elementos 94 (plutonio) a través de 102 (nobelio) entre 1940 y 1958. Seaborg también sugirió una serie de elementos de superactinida, con números atómicos 122 a 153, pero hasta el momento ninguno de estos ha sido sintetizado o detectado.


