¿Cuál es la historia de los elementos? Información sobre los elementos de la tabla periódica, isótopos, configuración electrónica, hibridación, reactividad de los elementos.
ELEMENTO, una sustancia que no puede descomponerse o disolverse en sustancias más simples por medios químicos ordinarios. También puede definirse como una sustancia que debe ganar masa al someterse a una reacción química.
Hay 118 elementos conocidos. De estos, 94 se encuentran en la naturaleza en cantidades medibles. El resto se han producido sintéticamente en laboratorios. Los elementos pueden combinarse en unos cuatro millones de compuestos. Alrededor del 95% contienen carbono y se denominan compuestos orgánicos.
Los elementos están formados por átomos que consisten en un centro muy denso, el núcleo, rodeado a distancias relativamente grandes por electrones. El núcleo contiene protones, que son partículas con cargas eléctricas positivas, y neutrones, que son eléctricamente neutros. Los electrones tienen carga negativa. La masa de un protón y de un neutrón es aproximadamente la misma, y la masa de cada uno es unas 1840 veces la de un electrón. Los protones y los neutrones son retenidos en el núcleo por otras partículas fundamentales, como los mesones.
Todos los átomos de un elemento contienen el mismo número de protones cargados positivamente en el núcleo y electrones cargados negativamente fuera del núcleo. Sin embargo, no todos los átomos de un elemento contienen el mismo número de neutrones.
Fuente : pixabay.com
Historia.
Los antiguos griegos tenían una variedad de opiniones sobre la composición elemental de la materia. Anaxímenes de Mileto (siglo VI a. C.) creía que el agua era el único elemento, mientras que Empédocles de Agrigento (siglo V a. C.) y Aristóteles (siglo IV a. C.) creían que había cuatro elementos: tierra, fuego, aire y agua. Se pensaba que estos elementos estaban relacionados entre sí a través de cuatro cualidades: frialdad, humedad, calor y sequedad, que también daban a los elementos sus características. Se pensaba que un elemento podía transformarse en otro cambiando las cualidades.
Durante la Edad Media se idearon muchas variaciones de las teorías de Aristóteles. En los años 1500, por ejemplo, Paracelso añadió tres principios: azufre, mercurio y sal, a los cuatro elementos. Sintió que estos principios tenían que estar en equilibrio en el cuerpo para una buena salud.
En el mundo antiguo se conocían y utilizaban nueve elementos: carbono, cobre, oro, hierro, plomo, mercurio, plata, azufre y estaño. Los alquimistas separaron otros elementos de sus compuestos, y antes de 1600 se identificaron el antimonio, el arsénico, el bismuto y el zinc. El fósforo se aisló durante la década de 1600, mientras que varios elementos, incluidos el hidrógeno, el nitrógeno y el oxígeno, se aislaron en la década de 1700. Alrededor de 30 elementos se conocían en 1800 y más de 80 en 1900.
El uso moderno de la palabra “elemento” data de Boberto Boyle en 1661, quien describió los elementos como “cuerpos primitivos y simples, o perfectamente separados; los cuales, no estando formados por ningún otro cuerpo, ni unos por otros, son los ingredientes de los cuales se componen inmediatamente todos los llamados cuerpos perfectamente mezclados, y en los que finalmente se disuelven”.
Para identificar una sustancia como elemento y clasificarla correctamente, primero es necesario poder separar el elemento de sus compuestos. Por ejemplo, en su lista de 33 elementos publicada póstumamente a principios del siglo XIX, el químico francés Antoine Lavoisier incluyó 6 compuestos. Con las técnicas disponibles en ese momento, estos compuestos no podían descomponerse en sustancias más simples. Segundo, es necesario tener pesos atómicos confiables. A mediados del siglo XIX esto fue posible gracias al trabajo de químicos como Gay-Lussac, Berzelius, Faraday, Dumas y Prout. Finalmente, había que conocer un número suficiente de elementos para poder definir claramente las relaciones entre ellos. A mediados del siglo XIX se conocían unos 60 elementos, suficientes para construir un sistema de clasificación.
El primer intento real de clasificar los elementos fue realizado alrededor de 1826 por el químico alemán Johann Wolfgang Dobereiner. Con su observación de las tríadas, Dobereiner demostró que en ciertos tríos de elementos, como el calcio, el estroncio y el bario, algunas de las propiedades del elemento intermedio eran predecibles en términos de las propiedades de los otros dos elementos. Los elementos de cada tríada se ordenaron por peso atómico.
En la ley de las octavas de John Newlands (1863) los elementos se ordenaban según su peso atómico en ocho columnas de siete elementos cada una. Los ocho elementos de las filas horizontales mostraron propiedades repetitivas. Por ejemplo, en la tabla de Newlands, los elementos número 8 (flúor), 15 (cloro) y 29 (yodo) son similares, mientras que 22 (cobalto y níquel), 36 (paladio) y 50 (platino e iridio) son similares. . Estos elementos difieren en múltiplos de siete.
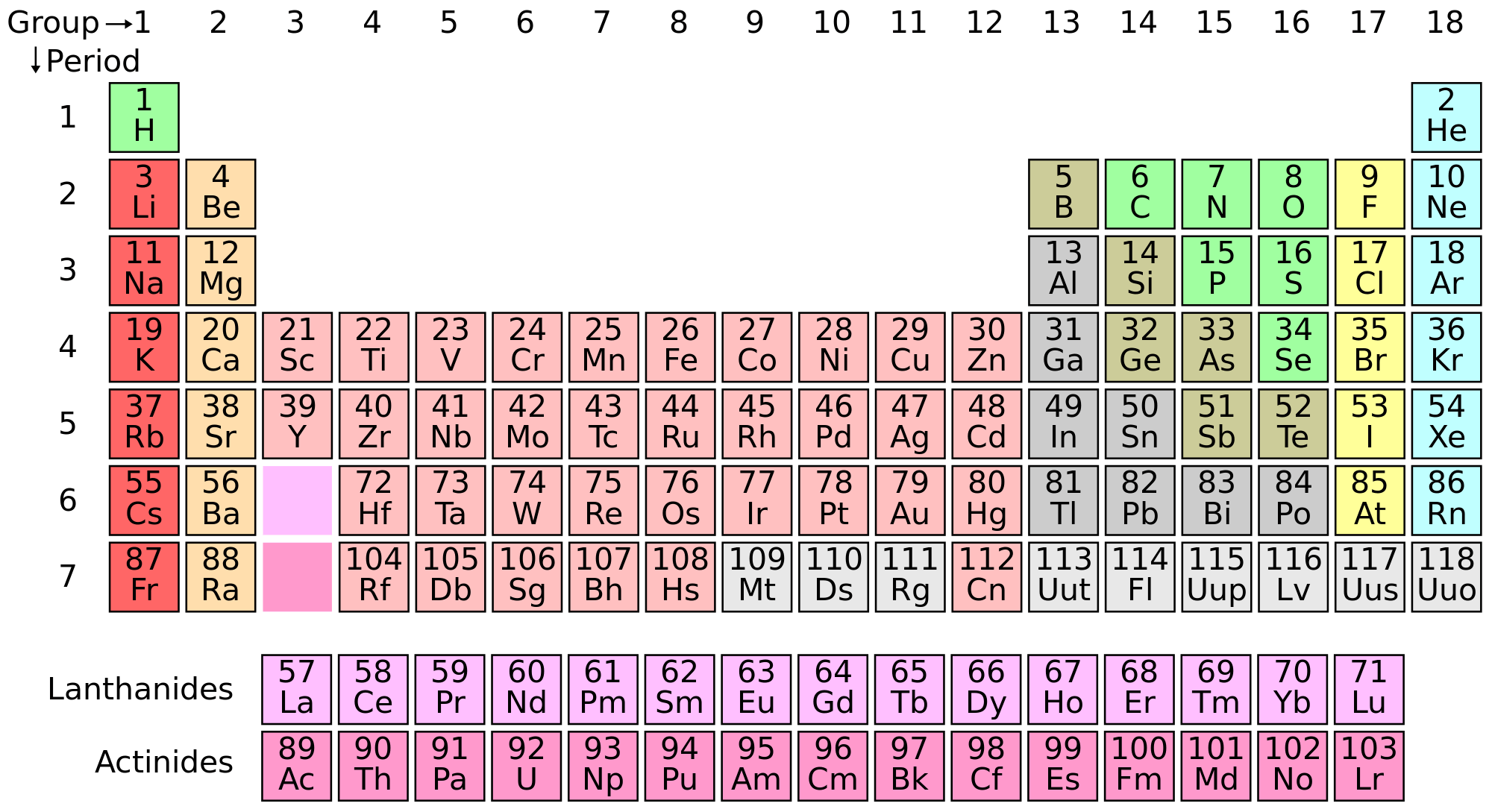
En 1869, el químico ruso Dmitri I. Mendeleyev publicó su ley periódica y tabla de elementos. Esta tabla enumeró los elementos generalmente en orden creciente de peso atómico. También separó el hidrógeno de los otros elementos colocándolo en su propio período, y dejó espacios en blanco para elementos no descubiertos. La tabla se publicó con los elementos en filas horizontales. Cada fila horizontal se conoce como período o serie; cada fila vertical se conoce como familia o grupo. Las familias exhibían propiedades similares, tanto que Mendeleyev fue capaz de predecir las propiedades de los elementos entonces no descubiertos galio, escandio y germanio.
Dos elementos no se colocaron en las posiciones indicadas por sus pesos atómicos. Mendeleyev insistió en que el telurio (peso atómico 127,60) debería preceder al yodo (126,90) y que el cobalto (58,93) debería preceder al níquel (58,71). El orden en estos dos casos se basó en las propiedades de los elementos. La tabla de Mendeleyev se basó en el hecho de que las propiedades de los elementos y sus compuestos son funciones periódicas de sus pesos atómicos. Las irregularidades que reconoció no fueron explicadas hasta el siglo XX.
En 1914, el físico inglés Henry GJ Moseley bombardeó objetivos metálicos con electrones. Midió las longitudes de onda de los rayos X producidos y descubrió una relación simple y lineal entre la raíz cuadrada del recíproco de la longitud de onda y el orden de los elementos de Mendeleyev. Moseley concluyó que este aumento regular debe deberse a la carga del núcleo y que resulta de la adición sucesiva de un protón al núcleo en la progresión de un elemento al siguiente a través de la tabla periódica. El número de protones en un núcleo atómico se llama número atómico.
Cuando los elementos se organizan en orden creciente de número atómico, se demuestra que Mendeleyev estaba en lo correcto en los casos en que no siguió el peso atómico.
Isótopos.
Aunque cada elemento tiene un número característico de protones (el número atómico) en los núcleos de sus átomos, el número de neutrones puede variar. Así, el número total de protones y neutrones (el número de masa) en el núcleo puede variar. Cada una de las variantes de un elemento, idéntico en número atómico pero diferente en número de masa, se conoce como isótopo. Por ejemplo, el estaño tiene 10 isótopos naturales, cada uno con 50 protones en sus átomos pero con diferente número de neutrones. Del estaño que se encuentra en la naturaleza, 6,01° tiene 74 neutrones; 4,74″, 72; 32,75%, 70; 8,68%, 69; 23,84%, 68; 7,67%, 67; 14,28%, 66; 0,35%, 65; 0,68%, 64; y 1,01%, 62.
Un isótopo puede simbolizarse de varias formas. Por ejemplo, el isótopo de estaño con número de masa 120 puede escribirse tin-120, Sn120 o 120Sn. La masa de un átomo, medida en unidades de masa atómica (1 unidad de masa atómica = 1/12 de la masa del carbono-12), es casi igual a su número de masa. El estaño-120, por ejemplo, tiene una masa atómica de 119,93. El peso atómico de un elemento es la masa atómica promedio de los átomos que existen en la naturaleza, ponderada de acuerdo con su abundancia relativa. El peso atómico del estaño es 118,69.
Las propiedades químicas de los isótopos son similares, pero difieren las propiedades físicas que dependen de la masa. Hay 269 isótopos estables que ocurren naturalmente y más de 900 isótopos radiactivos, muchos de los cuales se han producido en el laboratorio.
Configuración electronica.
Los electrones atómicos tienen ciertas restricciones severas con respecto al volumen de espacio que cada uno puede ocupar. Más exactamente, las restricciones están en la probabilidad de que un electrón ocupe cierto volumen. Estas restricciones están especificadas por la teoría cuántica, que describe cada electrón en un átomo mediante un conjunto de cuatro números cuánticos. De acuerdo con el principio de exclusión de Pauli, dos electrones en un solo átomo no pueden tener el mismo conjunto de números cuánticos.
El número cuántico principal, n, describe de forma general el tamaño del átomo o su radio. Los principales números cuánticos están numerados del 1 al 7, el número 1 describe el nivel de energía más cercano al núcleo y el número 7 el más alejado del núcleo. Los electrones en un átomo ocurren en siete niveles de energía definidos y discretos, que pueden imaginarse vagamente como distancias del núcleo. Los electrones no pueden ocupar niveles de energía entre estos valores definidos. Dado que se necesita energía para mover un electrón negativo de un nivel de energía más cercano al núcleo positivo a un nivel de energía más alejado, se deduce que cuanto más cerca está un electrón del núcleo (cuanto menor es su número cuántico principal), menos energía necesita. posee.
El número cuántico secundario, I, describe la forma del volumen del espacio en el que el electrón se mueve un cierto porcentaje del tiempo, digamos el 90%. Las configuraciones electrónicas identificadas por los números cuánticos primario y secundario también se han descrito en términos de capas y subcapas que rodean el núcleo atómico. Las capas, correspondientes a los números cuánticos primarios, están representadas por las letras K, L, M, N, O, P y Q. Las subcapas, correspondientes a los números cuánticos secundarios, están representadas por las designaciones espectroscópicas, s, p , d y f. Esta terminología alternativa, utilizada durante muchos años por los espectroscopistas, surge del carácter de las líneas producidas en un espectrograma. Un electrón para el que 1 = 0 produce una línea nítida y, por lo tanto, se designa como un electrón s; 1=1 produce una línea principal; 1 = 2 produce una línea difusa; e I = 3 produce una línea fundamental. Así, un electrón en el segundo nivel de energía (n = 2), cuyo número cuántico secundario, I, es 1, puede escribirse como 2p. (La designación espectroscópica s no debe confundirse con el número cuántico de espín, s. No están relacionados).
El número cuántico magnético, m, describe la orientación en el espacio de un electrón con números cuánticos principales y secundarios dados. Esta orientación se realiza con respecto a un campo magnético externo, proporcionando un eje de referencia arbitrario.
El número cuántico de espín, s, describe si el espín de un electrón alrededor de su propio eje es en sentido horario o antihorario con respecto a un patrón externo.
Cuando los electrones tienen números cuánticos idénticos a excepción del espín, se dice que ocupan el mismo orbital. Un orbital puede considerarse como un volumen de espacio en el que se mueven los electrones y puede tener uno o dos electrones, pero no más.
Las restricciones sobre los números cuánticos principales requieren que el primer nivel de energía tenga un máximo de 2 electrones, ambos s (un orbital); el segundo nivel de energía tiene un máximo de 8 electrones (2s: un orbital y 6p: tres orbitales); el tercer nivel de energía tiene un máximo de 18 electrones (2s, 6p y 10d: cinco orbitales); el cuarto nivel de energía tiene un máximo de 32 electrones (2s, 6p, 10d y 14/—siete orbitales). El quinto nivel de energía tiene un máximo teórico de 50 electrones, mientras que el sexto puede tener 72 y el séptimo, 98. Debido a que en la actualidad sólo se conocen 105 elementos, no se encuentran estos números máximos de electrones.
Hibridación.
Los números cuánticos magnéticos, así como el fenómeno conocido como hibridación, establecen la estructura tridimensional de un átomo en sus compuestos. La hibridación resulta de la tendencia de los electrones con energías algo diferentes en diferentes subcapas s, p, d o f a adoptar posiciones de energía equivalentes. Por ejemplo, el carbono con número atómico 6 debe tener dos electrones s en su primer nivel de energía y dos electrones s y dos p en su segundo nivel de energía. Sin embargo, los electrones en el segundo nivel de energía hibridan de manera que el contenido de energía de cada uno es intermedio. Esta es la hibridación sp3 (una s y tres p). Como todos tienen carga negativa, los electrones se repelerán entre sí y la estructura geométrica necesaria en este caso debe ser un tetraedro. El ángulo del centro de un tetraedro a dos de sus vértices es de 109° 28′. Debido a la equivalencia de los cuatro electrones sp3 en el carbono, este ángulo se encuentra en el átomo de carbono, en el diamante, que es carbono puro, y en compuestos simétricos de carbono, como el metano, CH4.
Reactividad de los elementos.
La reactividad de un elemento depende de varios factores, incluido el complemento de electrones en la capa externa (electrones de valencia) y el tamaño del átomo. La escala de electronegatividad, que fue diseñada por separado por Linus Pauling y Robert Mulliken, clasifica los elementos según su tendencia a ganar o perder electrones. La escala asigna un número de 4,0 al flúor y de 0,7 al cesio. Cuanto más cerca está un elemento de 4.0, mayor es su tendencia a ganar electrones, mientras que cuanto más alejado está, mayor es su tendencia a perder electrones.
Si la diferencia de electronegatividad entre dos átomos de diferentes elementos en un compuesto es grande, el compuesto será iónico, como en el cloruro de sodio, NaCl. En este compuesto, se elimina un electrón del sodio, que forma un ion de sodio con carga positiva, y es absorbido por el cloro, que forma un ion de cloruro con carga negativa. Si la diferencia de electronegatividad entre los átomos es pequeña, como en el metano, CH4, se compartirán electrones y se formará un enlace covalente. El grado de covalencia se puede calcular a partir de la diferencia de electronegatividad entre los átomos constituyentes.
Si se aplica un potencial positivo lo suficientemente grande a los átomos, extraerá uno o más electrones, dependiendo de su magnitud. Debido a que los iones cargados positivamente resultan cuando se extraen electrones, estos potenciales se denominan potenciales de ionización. Si el electrón se arranca con facilidad, el potencial de ionización es pequeño. Una tabla de potenciales de ionización proporciona datos sobre la reactividad y las valencias de los elementos.
Estados elementales.
Los elementos pueden estar aislados en cada uno de los tres estados de la materia. El estado depende de la temperatura y la presión.
Los gases nobles son helio, neón, argón, criptón y xenón. Debido a que su capa de electrones más externa está completamente llena, normalmente no se combinan con otros elementos o incluso con átomos similares. Por lo tanto, solo hay un átomo por molécula de estos gases. La mayoría de los demás elementos gaseosos contienen dos átomos por molécula; por ejemplo, el hidrógeno es H» y el cloro es Cl2. Algunos elementos que son sólidos a temperatura ambiente se vaporizan bajo ciertas condiciones para formar moléculas gaseosas que contienen un número variable de átomos. Por ejemplo, el fósforo puede tener cuatro átomos por molécula, P2, oa temperaturas más altas, dos átomos por molécula P2. El vapor de azufre, dependiendo de la temperatura, puede ser S3, S6 o S8.
Algunos de los elementos, como el bromo, el Br2, el mercurio, el Hg y quizás el galio, el Ga, son líquidos a temperatura ambiente.
Los elementos sólidos generalmente forman estructuras cristalinas de varios tipos. La forma del cristal depende directamente de la disposición de los átomos del elemento.
Los elementos pueden existir en dos o más formas diferentes, como oxígeno, O2 y ozono, O3; selenio gris y rojo; y fósforo blanco y rojo. El fenómeno de diferentes formas de un mismo elemento se conoce como alotropía. El término polimorfismo también se usa para diferentes formas cristalinas de un elemento.


