En este artículo encontrarás diferentes ejemplos de enlaces covalentes, uno de los tipos más comunes de enlaces químicos en los que dos átomos comparten un par de electrones. Descubre cómo se forman y sus características principales, así como su importancia en la estructura de moléculas esenciales para la vida, como el ADN y las proteínas.
Ejemplos de Enlaces Covalentes
Los enlaces covalentes son el tipo de enlace más común y más importante. Es un enlace entre los átomos dentro de una molécula y forma los enlaces más fuertes en cualquier parte. Los enlaces covalentes son enlaces químicos entre dos átomos no metálicos. Se forma un enlace covalente entre los átomos, cuando comparten uno o más pares de electrones entre sí. Estos pares compartidos crean un enlace entre los átomos, que los une en una unidad singular, como una molécula. Estos electrones compartidos giran en sus capas más externas. Una capa exterior completa necesita ocho electrones.
Los electrones en esta capa externa se llaman electrones de valencia. El número de electrones de valencia depende del tamaño del átomo. Los electrones luego rodean el átomo de la misma manera que los planetas orbitan las estrellas. Se desarrolla un camino alrededor del núcleo atómico. La primera capa siempre contiene solo dos electrones. Las capas externas después de esa capa generalmente contienen hasta ocho. Por ejemplo, si un átomo contenía ocho electrones, los dos primeros orbitarían muy cerca del núcleo atómico. Los siguientes seis orbitarían un poco más lejos. Cada átomo quiere una cáscara externa completa. Desea tener ocho electrones en la capa más externa. En este ejemplo, el átomo quiere ocho electrones en la capa externa, pero solo tiene seis. Por lo tanto, el átomo tomará prestados electrones de otro átomo. Cuando este enlace químico tiene lugar, se forma un enlace covalente.
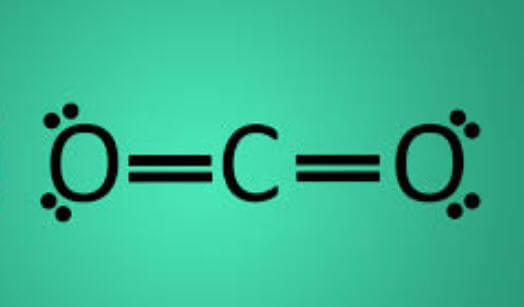
Los enlaces covalentes se pueden dividir en dos grupos: Simple y Gigante. Aunque ambos son similares, hay algunos factores distintivos. Por ejemplo, los enlaces covalentes gigantes tienen puntos de fusión y ebullición relativamente altos, mientras que los enlaces covalentes simples tienen un punto de fusión y ebullición relativamente bajos. Esto se debe a las fuerzas intermoleculares de atracción. Con enlaces covalentes gigantes, los enlaces entre capas son muy fuertes. Sin embargo, con un enlace covalente simple, los enlaces entre los átomos tienen un fuerte enlace intermolecular, pero no hay enlaces entre las moléculas, por lo que tiene un punto de fusión y punto de ebullición relativamente bajo.
Cuando dos átomos que comparten electrones atraen electrones con la misma fuerza, se forma un enlace covalente no polar. Un enlace covalente no polar es un enlace donde los electrones compartidos se comparten por igual. Por otro lado, un enlace covalente polar es un enlace covalente en el que los electrones compartidos son más atraídos a uno de los átomos que el otro. Es más probable que los electrones triturados estén cerca del átomo cuya electronegatividad es mayor.
1. agua
Un ejemplo es el agua. El agua consiste en un enlace covalente que contiene hidrógeno y oxígeno unidos para formar H2O. En esta molécula atómica, dos átomos de hidrógeno comparten sus electrones individuales con el átomo de oxígeno, que a su vez comparte sus propios dos electrones. Este es un ejemplo de un enlace covalente, que se crea debido a la mayor electronegatividad del oxígeno.
2. Diamantes
Un diamante es un ejemplo de enlace covalente gigante de carbono. Un diamante tiene una estructura molecular gigante. Cada átomo de carbono está unido covalentemente a otros cuatro átomos de carbono. Los electrones son tomados de estos otros átomos de carbono. Hay una cantidad tremenda de energía necesaria para separar los átomos en un diamante. Esto se debe a que un enlace covalente es fuerte y un diamante contiene cuatro enlaces covalentes. Esto hace que el punto de fusión y ebullición del diamante sea muy alto.
3. Caucho vulcanizado
Otro ejemplo es el caucho vulcanizado. El caucho es pegajoso cuando está caliente y frágil cuando está frío. En 1939, Charles Goodyear accidentalmente dejó caer una mezcla de azufre y caucho natural en una estufa caliente. La mezcla se calentó y se volvió dura y elástica, formando caucho vulcanizado. ¿Que pasó? Los enlaces covalentes transformaron el azufre y el caucho natural en el caucho vulcanizado cuando se calentó. Cambió porque los enlaces covalentes entre el azufre y el caucho cambiaron.


