La principal diferencia entre el número atómico y el número másico es que el número atómico indica el número de protones presentes en un átomo, mientras que el número másico indica el total del número de protones y el número de neutrones presentes en un átomo.
Si bien estos dos números comparten características comunes, revelan información bastante diferente sobre los átomos. Cada uno de estos números son medidas de características específicas de átomos. Debido a las leyes que dictan los átomos y las partículas que componen los átomos, a menudo se puede suponer con razón que si uno es más alto en un átomo en particular, entonces el otro también será superior en ese átomo. Algunas excepciones pueden aplicar.
Masa atomica
La masa atómica se mide en unidades de masa atómica, a menudo indicadas con la abreviatura ‘amu’. Una unidad de masa atómica es igual a 1/12 de la masa de un átomo de carbono-12. Para indicar que en gramos, un amu es igual a aproximadamente 1.66 × 10-24 gramos. Estos son números bastante pequeños en relación con la mayoría de las mediciones que se llevan a cabo en la vida diaria, pero los científicos han desarrollado formas de medir estas cantidades con una precisión constante. La espectrometría de masas es uno de los métodos más comunes utilizados para medir la masa atómica de un átomo.
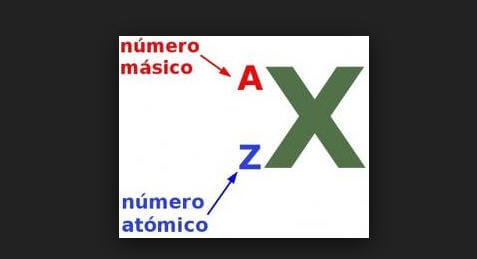
Gran parte de la masa en un átomo se encuentra en el núcleo del átomo y está en forma de protones y neutrones. Cada una de estas partículas pesa aproximadamente una unidad de masa atómica. El número de masa es el recuento de estas partículas y, por lo tanto, el número de masa está muy cerca de la masa atómica.
Número atómico
El número atómico se refiere a la cantidad de protones en el núcleo. A menudo se denota usando el símbolo Z. El número de electrones en el átomo neutro es igual al número de protones en el núcleo y por lo tanto igual al número atómico del átomo.
Los números atómicos primero fueron asignados alrededor de 1913 por H. G. J. Moseley. Arregló los átomos en un orden basado en la observación de espectros de rayos X y luego numeró los átomos. Los elementos están ordenados en la tabla periódica por su número atómico.
Resume
Ya puede que sepa cuán estrechamente relacionados están estos dos números. Si el número atómico es alto, se puede esperar que la masa atómica también sea alta. Esto es el resultado de los protones numerados en el número atómico que representan una fracción de la masa en el núcleo.
Hay varios otros números significativos al examinar átomos. Estos incluyen peso atómico que está estrechamente relacionado con la masa atómica y fue la base de la ley periódica de Mendeleev.


