¿Qué son los metaloides?
Los metaloides o semimetales son un tipo de elementos químicos que muestran un comportamiento intermedio entre metales y no metales, en términos de problemas de ionización y propiedades de unión.
Sin embargo, no es fácil distinguirlos de los metales reales. Se logra solo a través de la revisión de sus propiedades de conducción eléctrica. Además, generalmente son muy variados en su forma y color.
La lista de metaloides cubre los siguientes elementos:
- Boro (B).
- Silicio (Si).
- Germanio (Ge).
- Arsénico (Ar).
- Antimonio (Sb).
- Telurio (Te).
- Polonio (Po).
- Astatus (At).
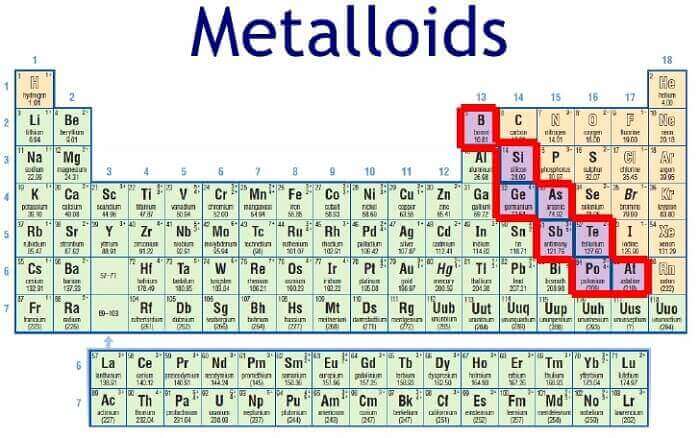
Características de los metaloides
1. Ubicación en la tabla periódica
Los metaloides se encuentran, dentro de la Tabla Periódica, en una diagonal que desciende desde el boro hasta el astato, dispersos entre las columnas 13, 14, 15, 16 y 17, y dividiendo la Tabla en dos. Los elementos que se encuentran en el medio de la derecha no son metálicos, y los que se encuentran a la izquierda son metálicos.
2. Forma y coloración.
Los metaloides son muy variados en su forma y color. Pueden ser brillantes u opacos, y muchos de ellos tienen más de un estado alotrópico, es decir, diferentes presentaciones según su estructura molecular. El arsénico, por ejemplo, puede ser gris, amarillo o negro, dependiendo de su versión alotrópica. El silicio, de manera similar, puede mostrarse como un cristal sólido brillante o como un polvo amorfo y amarronado.
3. Conducción eléctrica.
La mayoría de los metaloides son semiconductores (transmiten electricidad en una sola dirección) en lugar de conductores completos y se distinguen de los elementos metálicos. Sin embargo, son conductores mucho mejores que los elementos no metálicos (aislantes), por lo que a menudo se usan en la industria de fabricación electrónica.
4. Conducción térmica.
Al igual que con la electricidad, los metaloides conducen la energía térmica mucho mejor que los elementos no metálicos, sin alcanzar la alta conductividad de los metales. En general, no se consideran buenos conductores de calor.
5. Reactividad
Dada su condición intermedia, los metaloides reaccionan de manera diferente dependiendo de si están en presencia de un elemento metálico (luego reaccionan como no metálicos) o un elemento no metálico (luego reaccionan como un metal). Tienen afinidad por los diferentes elementos, dependiendo de cada uno, y es por eso que generalmente se encuentran en minerales junto con ellos, como uranio, plomo, azufre, etc.
6. Toxicidad
Aunque algunos metaloides, como el arsénico, son indispensables para la formación de moléculas vitales y se encuentran en los cuerpos de los seres vivos, pueden representar un peligro para la salud.
El envenenamiento por boro o arsénico en sí (altamente tóxico) puede ser letal; y el polonio, por otro lado, es un elemento tóxico y altamente radiactivo, es decir, emite partículas alfa que son dañinas para la salud, ya que son potencialmente cancerígenas, inmunosupresoras y mutagénicas.
7. Estados de agregación
La mayoría de los metaloides generalmente se muestran en estado sólido a temperatura ambiente, ya sea en forma de cristales (como el arsénico) o bloques opacos y quebradizos (como el germanio). Sin embargo, algunos tienen propiedades curiosas en términos de cambio de fase. Por ejemplo, el arsénico pasa directamente de sólido a gas (sublimación) en presencia de calor (y a presiones atmosféricas normales).
8. Propiedades atómicas
Los metaloides son muy diversos en su caracterización atómica. Hay algunos con gran peso atómico, como el polonio (127.60) o el antimonio (121.76), y otros bastante ligeros, como el boro (10.81) y el silicio (28.08).
Lo mismo sucede con sus densidades, que van desde 2,37 g / cm3 (boro) a 9,32 g / cm3 (polonio) y con su configuración electrónica en la última capa: 3 (boro), 4 (silicio, germanio), 5 (arsénico, antimonio), 6 (telurio, polonio) y 7 (astato).
9. Abundancia
Algunos metaloides son extremadamente abundantes en la corteza terrestre, como el silicio, que forma numerosos compuestos llamados silicatos, o también arsénico. El boro, por otro lado, existe en abundancia, pero como parte del mineral llamado bórax, ya que no existe en un estado libre y puro en la naturaleza. El polonio, por otro lado, es bastante raro y aparece solo como parte de ciertos minerales de uranio; y el antimonio se encuentra en porcentajes muy pequeños en la corteza terrestre.
10. Utilidad
La mayoría de los semimetales se utilizan para la fabricación de dispositivos electrónicos y elementos semiconductores, como rectificadores, transistores, diodos, circuitos integrados o incluso, como en el caso de silicio, chips y microprocesadores. Sin embargo, su variedad les permite para muchos usos diferentes.
Por ejemplo, algunos isótopos de boro son útiles en la absorción de neutrones dentro de las centrales nucleares, tanto en funcionamiento como en mecanismos de regulación de reacciones atómicas.


