¿Qué sucede con el calentamiento durante los cambios de fase? ¿Cómo se produce el derretimiento y la congelación y cuál es el papel del calor durante el cambio de estado?
En un día caluroso de verano, a menudo usamos hielo para enfriar un vaso de agua. Cuando el hielo se derrite, el agua se enfría casi a la temperatura de congelación. Si coloca el vaso donde el sol brilla sobre él, el agua permanece aproximadamente a esta misma temperatura hasta que todo el hielo desaparece. La energía radiante del sol se transforma en calor en el vaso de agua. Sin embargo, el agua no se calienta hasta que todo el hielo se derrita.
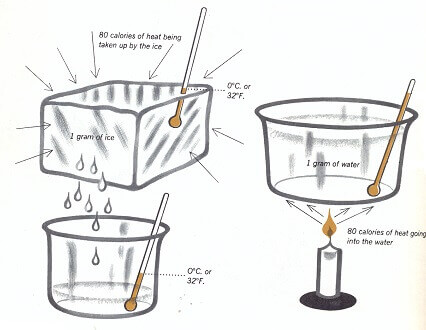
A menudo ha utilizado un termómetro para encontrar la temperatura de algo. Los termómetros muestran qué tan caliente o frío está un material. Pero no muestran cuánto calor se agregó o se eliminó del material para que alcanzara esta temperatura. En el sistema métrico, la cantidad de calor se mide en una unidad llamada caloría. Una caloría es la cantidad de calor necesaria para elevar la temperatura de 1 gramo de agua 1 ° centígrado. En el sistema inglés, la cantidad de calor se mide en la Unidad Térmica Británica, abreviada B.T.U. Esta es la cantidad de calor necesaria para elevar la temperatura de 1 libra de agua 1 ° F.
Es probable que pensemos que la calefacción siempre eleva la temperatura de las cosas. Pero el calentamiento también puede provocar un cambio de estado sin elevar la temperatura de un material. Cuando el hielo se derrite, se absorbe calor. Este calor hace que las moléculas se muevan con mayor libertad de modo que formen un líquido. Para convertir 1 gramo de hielo en agua se necesitan aproximadamente 80 calorías de calor. En lugar de calentarse, el agua permanece a la misma temperatura que el hielo hasta que se derrita todo el hielo. Si luego se agregan 80 calorías de calor a 1 gramo de agua, se calentará a 80 ° C, o 176 ° F. A esta temperatura, el agua está lo suficientemente caliente como para quemarle la mano.
Cuando algún sólido se derrite, se absorbe calor. Este calor se extrae de los materiales que rodean al sólido que se derrite. Sin embargo, la cantidad de calor no es la misma para todos los sólidos. Por ejemplo, solo se necesitan alrededor de 35 calorías para derretir 1 gramo de parafina. El hielo usa más calor para derretirse que casi cualquier otro sólido. Mientras cada gramo de hielo se derrite, absorbe alrededor de 80 calorías. Entonces, el hielo derretido elimina una gran cantidad de calor de todo lo que está cerca. Cuando se pone hielo en el agua, el calor que derrite el hielo proviene del agua. A medida que se libera este calor, el agua se enfría.

Cuando se quita el calor, el agua se enfría constantemente hasta que alcanza la temperatura de congelación. Luego, el agua permanece a esta temperatura hasta que se congela por completo. Aunque todavía se está quitando el calor, el agua no se enfría. La misma cantidad de calor necesaria para derretir el hielo debe eliminarse del agua para congelarlo. Luego, las moléculas se mantienen juntas para que formen un sólido.
Cada gramo de agua a la temperatura de congelación debe producir unas 80 calorías antes de que pueda congelarse. Por lo tanto, el agua helada da una gran cantidad de calor a lo que esté cerca. Mientras sale lo último de este calor, el agua permanece a la temperatura de congelación pero no se vuelve sólida. Después de que toda el agua se congela, su temperatura comienza a bajar nuevamente.