Los enlaces covalentes son enlaces fuertes con mayor energía de enlace. El enlace de hidrógeno es una atracción electrostática débil entre el hidrógeno y un átomo electronegativo debido a su diferencia de electronegatividad. Los enlaces de hidrógeno individuales son enlaces débiles, sin embargo, su presencia en gran número les proporciona una fuerza considerable.
El tema deja en claro que el artículo se basa en algunos conceptos de la química. Para aquellos de ustedes que conocen los conceptos básicos de los enlaces químicos, es fácil comprender que la discusión se trata de dos tipos de vínculos. En cuanto a otros, digamos que entre los muchos enlaces químicos que ocurren entre átomos y moléculas, vamos a discutir y diferenciar dos tipos muy importantes de enlaces, a saber, los enlaces de hidrógeno y los enlaces covalentes.
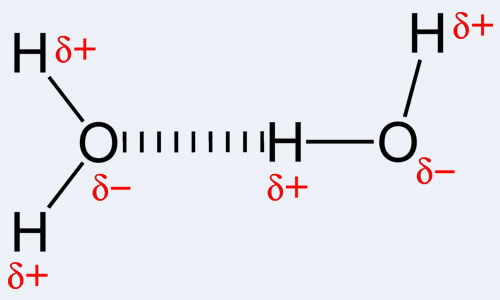
Muy a menudo las personas confunden los dos. Esto se debe a una definición vaga ofrecida para explicar estos relativos a otro tipo de bonos. La definición más simple que se ofrece es que un enlace entre dos elementos no metálicos suele ser covalente, mientras que un enlace entre un metal y un elemento no metálico es iónico. Estas definiciones son bastante generalizadas y existen muchas excepciones y contradicciones. En primer lugar, debe tenerse en cuenta que todos los enlaces entre dos elementos no metálicos no entran en la categoría de enlaces covalentes; también hay otros enlaces, uno de los cuales es un enlace de hidrógeno.
Por definición, un enlace covalente es una forma de enlace químico que se produce debido al intercambio de pares de electrones entre átomos iguales o distintos. El enlace covalente, a su vez, se refiere al equilibrio estable de fuerza (atractivo y repulsivo) entre átomos cuando comparten electrones. El intercambio permite que cada átomo involucrado obtenga una capa externa que es equivalente a una capa de valencia completa o capa exterior. Esto explica una configuración estable de electrones. En contraste con esto, un enlace de hidrógeno es en realidad el nombre de la atracción electrostática entre tipos especiales de moléculas, conocidas como moléculas polares. El enlace se produce de manera única cuando un átomo de hidrógeno que ya está unido a un átomo altamente electronegativo (uno de los tres: oxígeno, nitrógeno o flúor) experimenta otra fuerza de atracción de un átomo cercano que también es altamente electronegativo.
Tenga en cuenta que el hidrógeno debe estar presente para que se produzca un enlace de hidrógeno, y de ahí el nombre del enlace. Además, uno de los tres átomos mencionados anteriormente debe estar unido a él. Esto se debe a que el nitrógeno, el flúor y el oxígeno son muy electronegativos, es decir, atraen electrones hacia ellos mismos. Esto hace que el hidrógeno se comporte como una partícula cargada positivamente ya que los electrones cargados negativamente han sido atraídos hacia el correspondiente átomo de nitrógeno, flúor u oxígeno. Por lo tanto, esta partícula de hidrógeno, que ahora es positiva, se atrae fácilmente hacia otro átomo electronegativo debido a su negatividad. Usar el nombre de enlace de hidrógeno para esta interacción química es más como usar un nombre inapropiado porque no hay un vínculo verdadero que se forme. En efecto, hay atracciones di-polar a di-pole.
Las interacciones que tienen lugar en los enlaces covalentes incluyen la unión de metal a metal, tres enlaces de electrones centrales dos, interacciones agostic, π-bonding y σ-bonding. De hecho, es notable que la covalencia es la mayor entre los átomos que tienen electronegatividades similares. Esto implica que los dos átomos no necesitan ser del mismo elemento, sino que deben tener una electronegatividad que sea comparable y cercana para permitir enlaces más fuertes. A diferencia de esto, los enlaces de hidrógeno son intermoleculares, es decir, se producen entre moléculas o entre diferentes partes de una molécula. Los enlaces de hidrógeno son bastante fuertes; más fuerte que las fuerzas de Van der Waals, pero son más débiles que los enlaces covalentes y iónicos. Los ejemplos de moléculas en las que se produce el enlace de hidrógeno incluyen agua y algunas moléculas orgánicas, como proteínas, ADN, etc.
Resumen
- Enlace covalente: un enlace químico que se produce debido al intercambio de pares de electrones entre átomos iguales o distintos, enlace covalente se refiere al equilibrio estable de fuerza (atractivo y repulsivo) entre átomos cuando comparten electrones, el intercambio permite que cada átomo involucrado para obtener una capa exterior que es equivalente a una capa exterior de valencia completa o capa exterior; un enlace de hidrógeno es la atracción electrostática entre tipos especiales de moléculas, conocidas como moléculas polares. El enlace se produce únicamente cuando un átomo de hidrógeno ya unido a un átomo altamente electronegativo (uno de los tres: oxígeno, nitrógeno o flúor) experimenta otra fuerza de atracción de un átomo cercano que también es altamente electronegativo
- La unión covalente puede ocurrir entre una gran variedad de átomos; los enlaces de hidrógeno requieren hidrógeno y uno de oxígeno, nitrógeno o flúor
- El enlace covalente es más fuerte que los enlaces de hidrógeno


